
Binlerce insanı öldüren hatalı ilaçlar!
Bu yedi şok edici FDA hatası, binlerce insanın hayatına mal olan tehlikeli reçeteli ilaçları içerir.
ABD Gıda ve İlaç İdaresi’ndeki iyi dostlarımızın görevi, vücudumuza koyduklarımız konusunda okey vermektir. Ne yazık ki, karar verme işlemi her zaman olması gerektiği kadar kesin bir bilim değil . Aslında, FDA onarılamaz hasar ve hatta ölümle sonuçlanan oldukça büyük gaflar yaptı. İşte zararlı ilaçları piyasaya sokmuş birkaç felaket FDA hatası.

FDA Hatası 1 : Quaaludes

Quaaludes, 1962 ve 1985 yılları arasında uyku yardımcısı olarak kullanılan yatıştırıcı ve hipnotik bir ilaçtı. Ancak ilaç, tek kelimeyle (ve bu kelimenin her anlamında) uçurucuydu.. Biraz gözü kapatıp uyumak için ilacı alan çaresiz uykusuzluk ve anksiyete hastalarının çoğu manikleşmeye, kontrolü kaybetmeye , psikolojik sarsılmaya, kusmaya ve hatta bazen ölmeye başladı.
Ya da bağımlı oldular. Quaaludes artık bir Schedule 1 uyuşturucu (eroin ve LSD gibi) olarak kabul edilmekte, ancak FDA tarafından onaylanmadan önce bile, araştırmalar olası bağımlılık ve kötüye kullanım sorunlarına işaret etti. 1970’lere gelindiğinde Quaaludes son derece popüler bir sokak uyuşturucu haline gelmişti. Sadece 1982 yılında, Quaalude kullanımı sonucunda 2.764 acil servis ziyareti rapor edildi.
Bu aslında opioidler (morfin benzeri etkileri olan antestezikler ) söz konusu olduğunda oldukça tipik bir hikayedir. Aslında, morfin ve eroinin kendileri bir zamanlar tıp camiası ve halk tarafından yaygın olarak kabul edilen ağrı kesici harika ilaçlardı. Eroin bir zamanlar 1800’lerin sonlarında morfin yerine “güvenli, bağımlılık yapmaz” olarak pazarlandı.

FDA Hatası 2 : Cylert
İlk kez 1975’te piyasaya sürülen Cylert, merkezi sinir sistemini uyararak DEHB / ADD’yi tedavi etmeyi amaçladı. Çocuklara yönelik olarak, minimal kardiyovasküler etkilerini ilan ederek güvenliğiyle övündü. Ve gerçekten de, kalp problemleri yoktu – sadece karaciğer toksisitesi yaratıyordu !!!
FDA’ya bildirilen 13 akut karaciğer yetmezliği vakası vardı, bunlardan 11’i ölüm veya karaciğer nakli ile sonuçlandı. Bu sayı nispeten düşük görünse de, bildirilen rakam ilaç ve sağlık sorunu arasındaki bağlantıyı olumlu bir şekilde tanımaya yetiyordu. Herhangi bir nedenle, bağlantıyı doğrudan yapmak zor olabilir çoğu zaman
Sonuç olarak, bildirilen zararlı yan etki olayları genellikle gerçek olay sayısının sadece bir kısmıdır. Kutudaki uyarı etiketinde belirtildiği gibi (1999 sonrası eklendi ), karaciğer yetmezliği tahminleri “raporlama altında olduğu ve CYLERT tedavisinin başlatılması ile hepatik başarısızlığın oluşumu arasındaki uzun gecikmenin derneğin tanınmasını sınırlayabilir. Gerçek vakaların sadece bir kısmı tanınsaydı ve raporlansaydı, risk önemli ölçüde daha yüksek olabilirdi.” İbaresi mevcuttur .
Kar amacı gütmeyen Public Citizen grubuna göre (2005 yılında Cylert’in piyasadan kaldırılması için dilekçe veren), bildirilen karaciğer yetmezliği vakalarının yanı sıra, 1975 ve 1996 yılları arasında 193 “20 yaşından küçük hastalarda karaciğeri içeren olumsuz ilaç reaksiyonları” vardı.
Bununla birlikte, Cylert 2010 yılına kadar piyasada kaldı. O zaman bile, yaratıcısı Abbott Laboratories’in sözcüsü, ilacın güvenlik endişeleri yerine düşen satışlar nedeniyle durdurulduğunu belirtterek ilacın zararını kabul etmedi. Bununla birlikte, FDA’nın kendi referans arşivlerinde, “pemoline ile karaciğer yetmezliği için raporlama oranı, genel popülasyondaki karaciğer yetmezliğinin arka plan oranından 10 ila 25 kat daha fazladır” diyor.

FDA Hatası 3 : Darvon / Darvocet
Darvon / Darvocet, opioid ağrı kesici olarak 55 yıl boyunca piyasadaydı. Ve bu “kodein gücüne sahip narkotik olmayan analjezik!” sayesinde baş ağrısından kurtulmuş olsanız da, kalbiniz için korkunçzararlıydı. . Ciddi kardiyak anormallikler yaratan Darvon / Darvocet, sadece 1981-1999 yılları arasında 2.110 ölümden sorumluydu.
Piyasadan kalkma zamanı geldiğinde, FDA ayaklarını sürüyerek harika ( ! ) bir iş çıkardı. 1978’de ve daha sonra 2006’da (İngiltere’nin ilacı yasaklamasından bir yıl sonra) Darvon/ Darvocet’i yasaklamaları için tekrar dilekçe verildi. Ocak 2009’da, bir FDA danışma komitesi, satışın devam etmesini 14’e karşı 12 oyla kabul etti, Temmuz ayı geldiğinde FDA, “ölümcül aşırı doz riski” yazısını biraz daha görünür ve koyu renkli yazmaları şartıyla ilacın pazarlanmaya devam edeceğini açıkladı.
It wasn’t actually taken off the market until 2010, when a clinical trial used electrocardiograms to clearly demonstrate how just a standard dose of the pain reliever altered the heart’s electrical activity, potentially causing serious or life-threatening arrhythmias. Aslında 2010 yılına kadar piyasadan kaldırılmadı, bir klinik çalışmada, ağrı kesicinin standart bir dozunun kalbin elektriksel aktivitesini nasıl değiştirdiğini ve potansiyel olarak ciddi veya hayatı tehdit eden aritmilere neden olduğunu açıkça göstermek için elektrokardiyogramlar kullanılması ile zarar tam ispat edilene kadar .
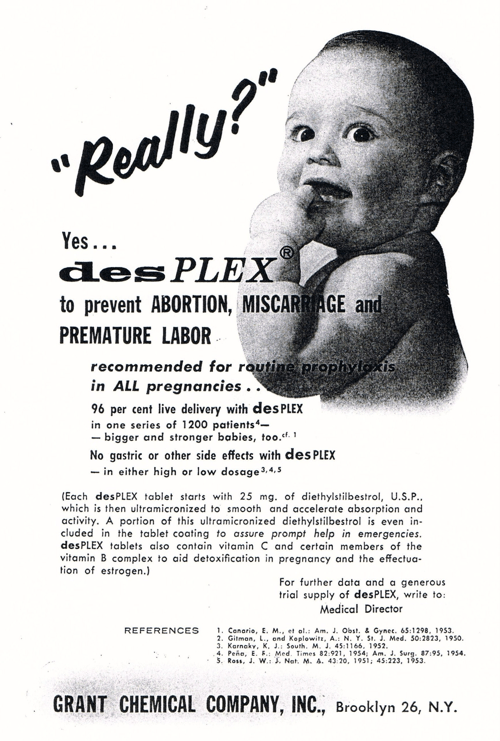
FDA Hatası 4 : DES
İşte daha da şok edici bir FDA hatası : Sentetik bir östrojen formu olan DES, sağlıklı bir bebek sahibi olmayı tercih eden anne adayına pazarlandı. Spontan kürtaj, düşük ve erken doğumu önlediği iddia edildi.
Aslında yukarıdakilerden herhangi birini başarmakta son derece başarısızdı. Bunun yerine, aşağıdakiler de dahil olmak üzere birden çok nesli etkileyen bir dizi başka sorun yarattı:
- Servikal ve Vajinal Kanser
- Doğum kusurları ve gelişimsel anormallikler
- Meme kanseri riskinin artması (ve meme kanserinden ölme riski yüksek)
- Çocukta kanser riski
- Doğurganlık ve gebelik komplikasyonlarında artan risk
- Erken menopoz
- Testis anormallikleri
DES, son derece yıkıcı, son derece etkisiz FDA hataları arasında gerçekten öne çıkıyor. Yaklaşık 5-10 milyon anne ve kadın fetüs DES’e maruz kaldı ve kullanıcı sayısı 1960’larda düşmesine rağmen (herkes ilacın amaçlanan şeyi yaparken işe yaramadığını fark etmeye başlaması nedeniyle ), çalışmalar kısa sürede hamileliğin ilk beş ayında DES alan annelerin üreme sistemleriyle ilgili komplikasyonlardan muzdarip olma olasılığının daha yüksek olduğunu gösterdi. FDA sonunda 1971’de yasakladı.
DES’in zararlı komplikasyonları hem ilacı alan kadını hem de çocuklarını etkileyebilirken, ailenin üçüncü nesli için potansiyel risk bile vardı. Başka bir deyişle, bu ilacı alan kişinin torunları sağlık komplikasyonlarına maruz kalabilir. Hala da kalıp kalmadıkları ile ilgili bir çalışma yok maalesef

FDA Hatası 5 : PTZ/Metrazol
PTZ/Metrazol şizofreni ve diğer psikiyatrik durumları tedavi etmek için konvülsif tedavi sağlamak için kullanıldı. Başlangıçta, bir dolaşım ve solunum uyarıcısı olması amaçlanıyordu, ancak nörolog ve psikiyatrist Ladislas J. Meduna yüksek dozların kasılmalara neden olduğunu keşfetti, bu sayede şizofreni hastalarını tedavi etmeye karar verdi.
Meduna için kulağa ne kadar berbat gelse de, konvülsif tedavi aslında günümüzde hala kullanılan etkili, son çare bir psikiyatrik tedavidir. PTZ / Metrazol o zamandan beri konvülsif tedavi için tercih edilen mekanizma olarak elektrik şokları ile değiştirildi, bu tedavi etkili bir şekilde nöbetler sağlayarak (genellikle geçici) majör depresif bozukluk, mani ve katatoni muzdarip insanlara rahatlama sağlayabilir.
Konvülsif tedavi etkili olabilirken, PTZ /Metrazol aşırı derecede sarsıcı bir ilaçtı. Hastaların tahmini %42’sinde kontrol edilemeyen nöbetlere, çekilen kaslara ve kasılmaktan lırılan kemiklere ve omurga kırıklarına neden olduğu için 48 yıl sonra piyasadan çekildi.

FDA Hatası 6 Posicor
Yıllarca (hatta onlarca yıl) devam eden diğer birçok FDA hatasının aksine, yüksek tansiyon ve göğüs ağrısını tedavi etmeyi amaçlayan Posicor, onaylandıktan ve satışı serbest bırakıldıktan sonraki bir yıl içinde geri çağrıldı.
Başından beri, ilaç oldukça dengesiz ve sağı solu belli olmayan bir yapıda görünüyordu. İlk klinik araştırmalar ilacın potansiyel olarak tehlikeli düzensiz kalp atışlarına neden olduğunu gösterdi. Ayrıca Hismanal (antihistaminik), Propulsid (mide ekşimesi rahatlaması) veya Seldane (antihistaminik) ile birleştirilemedi beraber kullanılmaları risk yarattı. . Ve eğlenceli gerçekşu ki : Bu ilaçların ( etken maddelerin ) hepsi de o zamandan beri faydalarından daha ağır basan risklere sahip olduğu için kesildi.
Posicor bu ilaçlarla birleştirilemedi çünkü vücudun bu ilaçları işlemesine yardımcı olan karaciğer enzimlerinin aktivitesini azalttı. Sonuçlar ölümcül olabilirdi – Posicor geri çağrıldığı zaman, 25’in üzerinde ilaç onunla birlikte tehlikeli olarak kabul edildi ve 100 ölümden şüphelenildi.
FDA’nın kendi, oldukça abartısız kelimelerinde, Posicor ile ilgili komplikasyonlar “standart etiket uyarılarıyla pratik olarak ele alınamaz.”

FDA Hatası 7 : Vioxx
Artriti tedavi etmeyi amaçlayan anti-enflamatuar bir ilaç olan Vioxx, tarihteki en büyük geri çağırmalardan birine konu oldu. 1999’da onaylandıktan sonra, 20 milyondan fazla kişiye reçete edildi ve 2003’ün en yaygın reçete edilen ilaçlarından biriydi. Ertesi yıl geri çağrıldı.
Orijinal klinik çalışmalarda kalp krizi veya felç riskinin artmış olmadığı ortaya konmuş olsa da, daha sonraki çalışmalar ilaçla ilişkili çok sayıda kalp krizi olduğunu ortaya koydu. Vioxx’un tehlikeleri 2000 yılında FDA ve ilacın üreticisi Merck tarafından biliniyordu.
2001 yılında Cleveland Clinic’te kardiyolog olan Dr. Deepak L Bhatt, Merck’e Vioxx’un 2001 yılında şiddetli göğüs ağrısı olan hastalarda çalışılmasını önerdi. Şirket, bu tür bir çalışmanın tipik Vioxx kullanıcısını yansıtmayacağını söyleyerek reddetti.
Ancak, daha makul olan şey Merck’in satış konusunda daha endişeli olmasıdır. Sadece 2003 yılında Vioxx firmaya 2,5 milyar dolar getirdi. Bu nedenle, rahatsız edici çalışmaların bir geri çağırmaya veya daha fazla araştırmaya yol açmasına izin vermek yerine, 2002’de kutuya küçük bir uyarı eklendi.
Ancak sonunda, ilacın uzun vadeli etkilerini test etmek için denemeler yapıldı. Ancak bu deneme, katılımcılar arasında kalp krizi ve felç riskinin artması nedeniyle tamamlanamadı bile.
Sonunda ortaya çıkarılan firma içi bilgilerle, FDA’nın kendi bilim adamlarından biri olan Dr. David Graham, Vioxx’un kalp sorunlarıyla bağlantılı 27.000’den fazla kalp krizi veya ölümle ilişkili olduğunu tahmin etti.




